

糖原病I型
浜松医科大学 小児科 福田 冬季子
糖原病はグリコーゲン(糖原)の分解や合成に働く酵素(一部は輸送体)の欠損によって引き起こされる疾病です。14 種類以上の糖原病があり、JaSMIn通信特別記事 No.23では糖原病の全般について記載しました。今回は、糖原病I型について、長期的な経過や新しい治療法の開発にも焦点をあてて、記載したいと思います。
1.糖原病I型はどんな病気ですか?
私たちは、食事からのグルコースを、貯蔵できる物質、すなわちグリコーゲンとして肝臓に貯めておきます。空腹時には、グリコーゲンはグルコースに転換されて、肝臓から血液中に出て利用されます。
グルコース-6-リン酸という物質が、グリコーゲンを分解する過程や、グルコースを新生する過程で生成されるのですが、糖原病I型は、グルコース-6-リン酸をグルコースに転換できないことにより発症します(図1)。糖原病I型では、グルコースをグリコーゲンとして肝臓に貯蓄することはできますが、グリコーゲンを分解し、グルコースを新生することができません。その結果、グリコーゲンが過剰に蓄積するために、肝臓は腫大し、グルコースを摂取しないと(空腹時には)、血糖が低下し、低血糖症状が出現します。
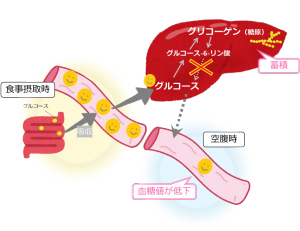
図1 糖原病I型のイメージ
2.どんな原因で発症しますか?
グルコース-6-リン酸がグルコースに転換される反応は、細胞内の膜状の小器官である「小胞体」で行われます。グルコース-6-リン酸がグルコース-6-リン酸トランスポーターにより小胞体に運ばれ(b)、小胞体でグルコース-6-リン酸がグルコース-6-ホスファターゼと反応し(a)、グルコースが新生されるのです。
糖原病I型にはIa型とIb型があり、Ia型はグルコース-6-ホスファターゼの欠損により、Ib型はグルコース-6-リン酸トランスポーターの欠損により発症します。Ia型もIb型も常染色体劣性の遺伝性形式で発症します。糖原病I型の約80%はIa型です。
Ia型の方ではG6PC遺伝子の2つのアレル(対立遺伝子)に、Ib型ではSLC37A4遺伝子の2つのアレルに疾病の原因となるバリアントを持っています。
日本人のIa型では、約90%にG6PC c.648G>Tのバリアントが、日本人のIb型では、約40%にSLC37A4 p.W118Rのバリアントが見いだされます。
3.どのような症状や所見がありますか?
糖原病I型では、生後3~4か月になると、肝臓の腫大や低血糖が出現するようになります。新生児期を過ぎて、哺乳間隔が長くなると、空腹時の低血糖症状が明らかになります。低血糖の程度が強いと、けいれんをおこすことがあります。肝臓の腫大は、腹部が膨満していることから気づかれます。身長の伸びが少なく、低身長が見られます。
糖原病I型では、低血糖の際に血中乳酸が上昇し、血中pHが酸性となる「乳酸アシドーシス」の状態になります(図2)。また、細胞内にグルコース-6-リン酸が高い状態であるため、中性脂肪のもとになるジヒドロキシアセトンリン酸も増加し、その結果として、中性脂肪(トリグリセライド)が増加します(図2)。高コレステロール血症や高尿酸血症もみられます(図2)。肝臓、腎臓、腸管にはグリコーゲンが蓄積しますが、糖原病I型では脂質代謝も障害されるため、肝臓、腎臓、腸管に、グリコーゲンだけでなく脂質も蓄積します。血小板の機能異常による鼻出血などの出血も見られます。
Ib型ではIa型の症状に加え、好中球減少や炎症性腸疾患が見られます。
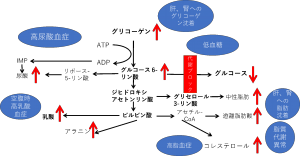
図2 糖原病I型の症状
4.どのように治療しますか?
低血糖を予防するために、空腹を回避し、少量頻回食や夜間持続注入を行います。治療用ミルクや非加熱のコーンスターチ療法を用います。血糖値を正常(70mg /dl 以上)に保ち、乳酸アシドーシスを予防します。ショ糖、果糖、乳糖、ガラクトースの摂取を制限します。
体調不良で、食事摂取ができないときには、重篤な低血糖やアシドーシスを発症する危険があるため、食事摂取不良な時には、グルコースの静脈投与を行います。
糖原病I型では、図2に示すような代謝のつながりから、低血糖だけでなく、高尿酸血症や脂質代謝異常症も生じますので、それらに対しても治療を行います。血糖のコントロールが良好になると、高尿酸血症や脂質代謝異常症も改善する傾向がありますが、薬物療法が必要な場合がほとんどです。高尿酸血症に対してアロプリノールなどの薬剤、脂質代謝異常症に対して、血中トリグリセライド500mg/dl未満を目標に、特に中性脂肪を低下する効果のある薬剤が選択されます。
Ib型では、好中球減少に対しG-CSF(顆粒球コロニー刺激因子)の投与や炎症性腸疾患に対する治療を実施します。
5.長期的な合併症について
糖原病I型の治療の基本は、食事療法を確実に行うことで、救急治療が必要な事態を回避するだけでなく、長期的な合併症の予防に役立ちます。しかしながら、食事療法で代謝のコントロール(血糖、トリグリセライド値、乳酸アシドーシスなどのコントロール)が良好であっても、肝臓、腎臓、腸管には、グリコーゲンと脂肪が蓄積し、長期的な合併症がしばしば発症します。長期的な合併症には、肝腫瘍と腎機能障害などがあります。
(1) 肝腫瘍
肝臓には10歳頃から、良性の肝細胞腺腫が形成されます。糖原病I型の肝細胞腺腫は、一般に炎症性肝細胞腺腫に分類されます。糖原病I型の肝細胞腺腫は多発したり、急速にサイズが大きくなったりすることがしばしば見られます。急速に肝細胞腺腫のサイズが大きくなると腺腫内に出血する危険性が生じます。また、肝細胞腺腫は肝細胞癌へと悪性化するリスクを持っています。
肝細胞腺腫・肝細胞癌の治療には、経皮的エタノール注入法、経皮的ラジオ波焼灼療法、肝部分切除があります。ラジオ波焼灼療法は比較的身体への負担が少ない方法です。肝細胞癌への悪性化が疑われる症例では、肝移植が行われる場合もあります。
(2) 腎機能障害
糖原病I型では、腎臓の合併症が高率に見られます。腎尿細管と腎糸球体の障害が見られます。
腎糸球体の障害は、まず、過剰濾過が出現し、微量アルブミン尿が検出されるようになります。徐々に巣状糸球体硬化をきたし、腎障害が進行するリスクがあります。腎機能障害の進行を予防するために、早期から治療を開始することが進められています。腎障害の進行を予防するために、糸球体の過剰濾過やアルブミン尿症が出現した場合には 、ACE 阻害薬やアンギオテンシン受容体ブロッカーを服用します。
腎結石が見られることもあります。低クエン酸尿症に対しクエン酸を補充し、高カルシウム尿症に対し、サイアザイド利尿薬などが使用されます。
慢性腎不全が進行する場合には、腎代替療法(透析、腎移植)が行われます。
(3) 長期的な合併症の定期検査について
長期的な合併症は、症状が表に現れにくいため、定期的に血液検査、尿検査、肝臓、腎臓の画像検査を受けることが大切です。
6.新しい治療法の開発
糖原病I型では、食事療法や薬物療法を継続して行い、代謝のコントロール(血糖、トリグリセライド、乳酸アシドーシスなどのコントロール)を良好に保つことが肝要です。
食事療法を積極的に継続することは必ずしも容易ではありません。また、食事療法によって、長期的な合併症を完全に阻止することは困難であると考えられているため、食事療法からより解放されることを可能にするため、また、長期的な合併症をより少なくするために、新しい技術を使った新しい治療法の開発がさかんに行われています。
近年の遺伝子治療に関する進歩には目をみはるものがあります。遺伝子に働きかける治療には、遺伝子置換療法や核酸医薬品による治療などがあり、脊髄性筋萎縮症などでは実際に患者さんに対する治療が行われています。
糖原病I型でも、遺伝子治療の開発研究がさかんに行われています。特にIa型では、動物実験で、長期的な効果を維持し、治療の効果を増強するために、さまざまな研究が行われ、米国では人に対する臨床試験も行われています。今後さらに、研究が進み、実臨床への応用が実現されることが期待されています。
7.さいごに
糖原病I型では、代謝のコントロール(血糖、トリグリセライド、乳酸アシドーシスなどのコントロール)をできるだけ良好に保つように、食事療法と薬物療法を実施するとともに、長期的な合併症(肝臓や腎臓など)を定期的に経過観察し、適切な治療を行うことが大切です。現在、新しい技術を利用した新しい治療法の開発が行われており、今後のさらなる進展が期待されています。
全文PDFは以下からダウンロードできます