

続・遺伝子治療について
東京慈恵会医科大学 総合医科学研究センター遺伝子治療研究部・小児科学講座
小林 博司
1. はじめに
2017年に大橋十也先生が通信特別記事No.9でわかりやすい記事を組まれています。今回、そのおさらいと最近の進歩についても述べてみました。続編としてお気軽に読んで頂ければと思います。なお、初めての方にも理解しやすいように前回記事の内容を一部踏襲しています。
2. 遺伝子治療って?
遺伝子(DNAの中でもタンパク質を作り出す情報を持つ部分)を体内の細胞に導入して病気を治す方法。たとえば先天代謝異常では、酵素などのタンパク質を作る遺伝子の異常(遺伝子変異)による病気の状態を、正常な遺伝子を導入することで治療します。
3. 遺伝子治療の方法は?
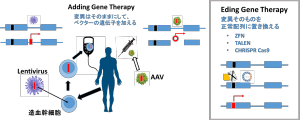
図 遺伝子治療の方法
遺伝子は細胞内の核にあるので、体外から投与した遺伝子は細胞内の核に到達して初めて効果を発揮します(厳密にはミトコンドリアにも遺伝子はありますが、現在遺伝子治療の対象になるのは核内の遺伝子のみです)。ウイルスの持つ「自己の遺伝子を細胞の核に入れる力」を利用する方法が最も多く用いられています。そのウイルスの遺伝子に治療遺伝子を組込みますが、このとき使うウイルスはベクター(=遺伝子を運ぶ物質)として病原性を排除してあり、近年はアデノ随伴ウイルス(AAV)、レンチウイルスが主に使われます。AAVでは直接静脈内、筋、脳内に注射する方法 (in vivo)が、レンチウイルスでは患者さんから骨髄細胞を採取して造血幹細胞を抽出しそれに感染導入させて、体内に戻す方法(ex-vivo)が用いられ、どの方法を選ぶかは疾患によります。この方法は元の遺伝子変異はそのままにしてウイルスベクター由来の遺伝子から治療タンパクを作らせるため「遺伝子付加」(Adding Gene Therapy)とも呼ばれ、現在行われている臨床試験*1や治験*2の主流になっています。
また最近もう一つの方法として、狙った遺伝子の並ぶ場所(=配列)に特異的に結合するタンパク質や核酸とその配列を切断する酵素(制限酵素)を組み合わせた人工物質を電気パルスやベクターなどで核内に到達させ、遺伝子異常部分のみを切断し正常遺伝子と置き換える、「遺伝子編集」(Editing Gene Therapy)という技術も出てきました(上図右側の枠内)。ジンクフィンガー(ZFN)、TALEN、クリスパー・キャスナイン(CHRISPR Cas9)といった技術の研究開発が進み、一部メディアで取り上げられています。これが実用化すれば狙った位置の遺伝子変異そのものを組換えることが可能になりますが、本格的な臨床試験はまだこれからです。
4. 遺伝子治療ですべての症状が改善する?
基本的には遺伝子を導入した組織や臓器の改善が主体です。例えばウイルスベクターを脳内投与した場合、骨や心臓などには効果が及びにくいと考えられます。ただし、いろいろな細胞に分化する骨髄の細胞(造血幹細胞)や代謝の中心となる肝細胞を治療して全身への効果を狙う方法は研究されていますが、その効果も患者さんの年齢や病気の進行度によって違い、いつでもすべて改善という訳には中々いきません。基本的に早期治療が効果的なので、対症疾患を発症前に見つけ出す為のスクリーニングの必要性も指摘されています。
5. 遺伝子治療のメリットは?
現在のウイルスベクターによる遺伝子治療は基本的に1回です。同じウイルスを再び投与すると免疫で排除されてしまうからです。この1回で非常に長期の効果があるのはわかっていますが、本当に一生に一回でよいのか、それとも補助的に別の治療法が必要かどうかは臨床研究を重ねる必要があります。ただ、酵素補充療法などは毎週又は隔週で繰り返し投与が必要であり、治療回数がはるかに少ないのは大きなメリットといえます。またex vivo法では患者さん本人の骨髄をベクターで遺伝子導入して戻すので、通常の骨髄移植で見られるドナー(提供者)から移植された細胞に対する重い拒否反応の心配はなく、ドナー探しの手間も要りません。
6. 遺伝子治療を受ければ、もう病気は遺伝しない?
前回の記事にもあるように、現在は遺伝子を卵子や精子等の「生殖細胞」に導入するのは禁止されています。これは現在の技術が完全ではないので、子孫にその影響を及ぼしてしまうことを避けるためです。少し前に中国のチームが受精卵の細胞に遺伝子治療を行い大問題になりました。ただし、将来遺伝子治療の技術の安全性・有効性が十分保障されれば、生殖細胞に遺伝子治療を施して病気の遺伝を阻止することも可能になるかもしれません。
7. 遺伝子治療のリスクは?
現在のウイルスベクターによる遺伝子治療では遺伝子の導入される染色体上の位置のコントロールはできないため、以前レトロウイルスベクターによる治療で白血病が起こってしまった事例がありました。また、アデノウイルスベクターで全身炎症性疾患を引き起こした事例も報告されています。これらは原因が詳細に検討され、回避する研究が進みました。例えばレンチウイルスベクターは自然に染色体に挿入される遺伝子の位置が腫瘍関連遺伝子の位置から遠いとされ、AAVでは染色体への挿入そのものが少なく、毒性も少ないとされています。実際これらを用いた最近の臨床試験でほぼ重大な事故はなく、だからこそ次に述べるように世界各国で薬事承認*3も進んでいるとも言えます。更に将来、前述の遺伝子編集技術が進めば遺伝子導入の位置のコントロールも可能になるかもしれません。
8. 今、どんな病気に遺伝子治療が行われているの?
世界でも特に日米欧で薬事承認されている対象疾患の数は、前回記事の書かれた2017年8月の時点での3疾患から大幅に進歩して、以下の表で示した通り9疾患(10製剤)になりました。実に3倍です!内訳は腫瘍(メラノーマ・白血病・リンパ腫)、眼疾患(レーバー黒内障)、免疫不全(ADA欠損症)、血液疾患(サラセミア)、神経筋疾患(SMA)、先天代謝異常(LPL欠損症)です。このうち日本でも3疾患が承認され、今年に入ってからも脊髄性筋萎縮症(SMA)のAAVによる治療が承認されています。
先天代謝異常ではLPL(リポ蛋白リパーゼ)欠損症が承認され(Glybera™ 表内1、2017年販売終了)、更に海外を中心に異染性白質ジストロフィー(MLD)、副腎白質ジストロフィー(ALD)、ムコ多糖症、ゴーシェ病、ファブリー病で治験*2が進んでいますが、現時点では承認はまだです。日本ではAADC(芳香族Lアミノ酸脱炭酸酵素)欠損症に対する遺伝子治療で臨床研究*4が行われています。
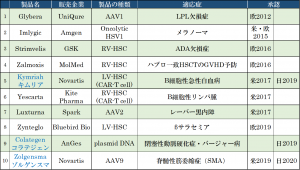
表 日米欧で保険承認された遺伝子治療(2020年6月現在) 青字:日本での承認
RV-HSC: レトロウイルス導入造血幹細胞 LV-HSC: レンチウイルス導入造血幹細胞
9. まとめ
このように遺伝子治療は現在、研究段階から臨床実用段階へ移行しつつあります。更なる安全性・有効性の追求など重要な課題はありますが、ライソゾーム病などの先天代謝異常症に対する遺伝子治療の実用化も遠くない段階に来ていると言えます。
*1臨床試験:臨床研究の中でも、薬・機器等による治療を行い人体に変化を伴う研究(介入研究)安全かつ有効な投与量や方法等を確認する目的で行う。
*2治験:臨床試験の中でも、薬事承認を得ることを目的として行う試験。事前に厚生労働省に届け出が必要。
*3薬事承認:国が薬や医療機器の製造販売を認めること。その多くが保険適応となる。
*4臨床研究:ヒトを対象に行われる全ての研究。
全文PDFは以下からダウンロードできます。