

グルコーストランスポーター1欠損症
東京女子医科大学 小児科学教室
総合母子保健センター 愛育病院 小児科
伊藤 康
1.はじめに
グルコーストランスポーター1(glucose transporter 1; GLUT-1)欠損症は、糖質代謝異常症に分類される先天性代謝異常症の1つです。輸送タンパク質の1種であるトランスポーターの異常のため、脳へのグルコースの輸送に支障をきたす病気なのです。誰もがこの病気のことをGLUT-1(グルットワン)欠損症(異常症)と呼ぶので、グルコーストランスポーター1欠損症とフルネームで呼ばれることはほとんどありません。本稿では、GLUT-1欠損症をトランスポーター異常症という観点で解説したいと思います。
2.GLUT-1欠損症の症状と診断
乳幼児期早期に、けいれん、異常眼球運動、無呼吸あるいはチアノーゼ発作で発症します。経過とともに、知的障害や、筋緊張低下、運動失調、痙性麻痺、ジストニアなどの運動障害が現れてきます。てんかんを合併することが多く、非てんかん性の運動失調、意識障害、麻痺、不随意運動、嘔吐などが発作性に現れることもあります。これらの発作性症状は、空腹、運動、体温上昇、疲労により増悪し、食事、睡眠、安静により改善することがこの病気の特徴です。
検査所見では血糖値が正常であるにもかかわらず、髄液糖が低いことがGLUT-1欠損症の診断の手がかりとなります。大多数にSLC2A1遺伝子における新規の突然変異を認めますが、家族例も報告されています 1-3)。

3.トランスポーターとトランスポーター異常症
イオンや生体代謝に関与する多くの有機物質は水溶性のため、脂質二重層により構成された細胞膜を通り抜けることはできず、細胞膜を通過するには特別な“細孔”構造を必要とします。これがイオンチャネルやトランスポーターなどの膜輸送タンパク質なのです 4)。
先天性のトランスポーター異常による病気として、GLUT-1欠損症以外にも、クレアチントランスポーター欠損症、チアミントランスポーター2欠損症、先天性葉酸吸収不全などが日本でもすでに報告されていますが、先天代謝異常症患者登録制度(JaSMIn)にはいまだ登録されていないのが現状です。患者さんの数が少ない疾患では、通常は有効な治療法が存在しないことが多いのですが、トランスポーター異常症の一部には特異的な治療法が存在していることが重要です。GLUT-1欠損症も、周知されてきたことにより診断がつき、多くの人がケトン食療法という効果のある治療を受けられるようになりました。
4.血液脳関門とグルコースの輸送
血液脳関門は有害な物質が脳内に侵入するのを防ぐためのシステムです。血管と神経細胞は直接には接しておらず、血管はアストロサイトによって包まれるようになっており、血管内皮細胞とアストロサイトが神経細胞を守るための血液脳関門を形成しています。GLUT-1は12回膜貫通型の膜結合性糖タンパク質で、血液脳関門における促進拡散型のグルコース輸送を行います。グルコースは、GLUT-1を介して毛細血管内皮細胞の血管内膜側で取り込まれ、血管外側膜で脳実質に放出され、その後グリア細胞(アストロサイトやオリゴデンドロサイト)や神経細胞に取り込まれます 3, 5)(図1)。
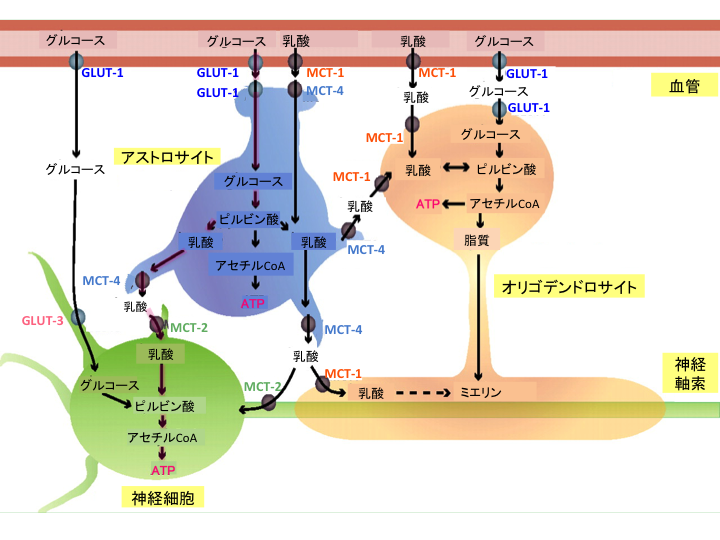
図1.血液脳関門とグルコースの輸送と代謝(文献5より引用、一部改変)
略語 GLUT-1、GLUT-3(グルコーストランスポーター1型、3型)
MCT-1、MCT-2、MCT-4(モノカルボン酸トランスポーター1型、2型、4型)
ATP(アデノシン三リン酸)はエネルギーが詰まった化学物質です。
GLUT-1の働きで血液中からアストロサイトに取り込まれたグルコースは解糖系で乳酸にまで分解されます。その乳酸はモノカルボン酸トランスポーター(monocarboxylate transporter; MCT)を介して神経細胞に輸送され、ミトコンドリアにおけるエネルギー(ATP)産生に使われます 5)(図1)。GLUT-1欠損症では、最初の段階で血液中からグルコースの取り込みができず、このメインの代謝経路(赤色のぼかしが入った経路)が障害されることにより、神経細胞はエネルギーを産生することができなくなり、脳は正常に機能できなくなります。GLUT-1蛋白の残存機能が75~100%では軽微な症状を示し、GLUT-1の働きを抑制する飲食物(カフェイン、アルコール)、薬剤(フェノバルビタール、抱水クロラール、テオフィリン)などの要因で症状が出るとされ、50~75%の場合はGLUT-1欠損症の中でも軽症型となります。アミノ酸配列へ大きな変化を与える遺伝子変異があるとGLUT-1の残存機能は50%となりGLUT-1欠損症の典型例となります 6)。
5.脳のエネルギー代謝に対するケトン食療法の作用
脳の神経細胞やグリア細胞の主要なエネルギー源はグルコースですが、若年成長期、長期にわたる絶食・飢餓でのグルコースの不足時には、肝臓で産生されたケトン体(β-ヒドロキシ酪酸やアセト酢酸)もエネルギー源として利用することができます 7, 8)(図2)。
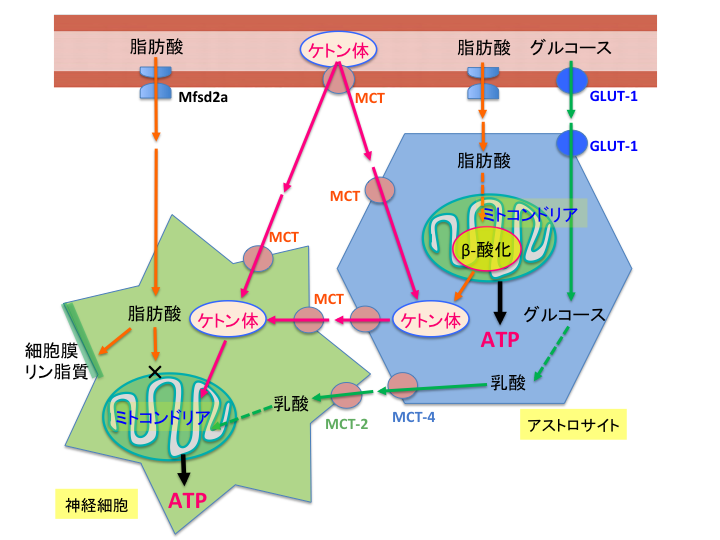
図2.脳のエネルギー代謝に対するケトン食療法の作用(文献7より引用)
血中のグルコースはGLUT-1でアストロサイトに取り込まれた後に乳酸に代謝されます。乳酸はMCTによって神経細胞に輸送され、ミトコンドリアのTCA回路でエネルギー(ATP)が産生されます(図2の緑色の経路) 7)。
トリアシルグリセロール(中性脂肪)の構成成分である脂肪酸も輸送タンパク質を介し、血中からアストロサイトや神経細胞に取り込まれます(図2のオレンジ色の経路)。アストロサイトは脂肪酸をいくらかはβ酸化で分解することができるようです。一方、神経細胞はβ酸化に関与する酵素活性が低く、脂肪酸を分解してATPを産生することができないようです。従って、脂肪酸は血液脳関門を通過することや、神経細胞内に入ることまではできるのですが、エネルギー源としては使われていないのです。グルコースをエネルギー源とする場合と比べて、脂肪酸の分解はATP産生の速度が遅く、酸素消費も多くなります。神経活動を長期にわたり持続的かつ迅速に行うにあたって、また低酸素にも弱い神経細胞としてはβ酸化からのエネルギー供給は適さないようです 7)。
肝臓において、2分子のアセチルCoAからケトン体が産生されます。ケトン体は水溶性であり、脂肪酸のようにアルブミンと結合する必要はないので、必要とする臓器に速やかに運ばれます。血中のケトン体は、MCTによりアストロサイトや神経細胞に取り込まれ、2分子のアセチルCoAに戻された後ミトコンドリアのTCA回路でATPが産生されます(図2のピンク色の経路)。ケトン体をエネルギー源として用いることは、グルコースと比べてより効率的であり、脂肪酸のβ酸化に頼らなくてよい点でより安全といえます 7, 8)。
GLUT-1欠損症では、脳におけるグルコースをエネルギー源とする経路(図2の緑色の経路)を介したエネルギー産生が障害されますが、ケトン体を代わりのエネルギー源とする代謝経路が存在してくれるので、ケトン食療法が最も優先される治療法となります。脳はエネルギー源として脂肪酸には依存しておらず、高脂肪/低炭水化物食であるケトン食療法では高脂血症による将来的な合併症にも注意を払わなければなりません。そういう意味では、定期的な血液検査において血中ケトンは高値を維持し、一方中性脂肪は正常値近くにコントロールできていることが重要といえます。
6.GLUT-1欠損症の治療の展望
ケトン食療法は、現在のところGLUT-1欠損症の第1選択の治療となっており、GLUT-1欠損症が疑われたならばできるかぎり早期に開始され、そして効果があれば成人期まで維持されるべきです。
最近、GLUT-1欠損症モデルマウスに対し、アデノ随伴ウイルスベクターを用いてヒトSLC2A1遺伝子を導入した結果、運動機能と低髄液糖の改善がみられたという研究成果が自治医科大学小児科から報告され、現在治験に向けて準備中とのことです 9)。

参考文献
1)Ito Y, Takahashi S, Kagitani-Shimono K, et al. Nationwide survey of glucose transporter-1 deficiency syndrome (GLUT-1DS) in Japan. Brain Dev. 2015; 37(8): 780-9.
2)Gras D, Roze E, Caillet S, et al. GLUT1 deficiency syndrome: an update. Rev Neurol (Paris). 2014; 170(2): 91-9.
3)Klepper J, Voit T. Facilitated glucose transporter protein type 1 (GLUT1) deficiency syndrome: impaired glucose transport into brain – a review. Eur J Pediatr. 2002; 161(6): 295–304.
4)安西尚彦,平田拓,遠藤仁.トランスポーターの異常と疾患−総論−.臨床化学.2005; 34(1): 27-32.
5)Rinholm JE, Hamilton NB, Kessaris N, et al. Regulation of oligodendrocyte development and myelination by glucose and lactate. J Neurosci. 2011; 31(2): 538-48.
6)Wang D, Pascual JM, Yang H, et al. Glut-1 deficiency syndrome: clinical, genetic, and therapeutic aspects. Ann Neurol. 2005; 57(1): 111-8.
7)Schönfeld P, Reiser G. Why does brain metabolism not favor burning of fatty acids to provide energy? Reflections on disadvantages of the use of free fatty acids as fuel for brain. J Cereb Blood Flow Metab. 2013; 33(10): 1493-9.
8)Elamin M, Ruskin DN, Masino SA, et al. Ketone-Based Metabolic Therapy: Is Increased NAD(+) a Primary Mechanism? Front Mol Neurosci. 2017; 10: 377.
9)Nakamura S, Osaka H, Muramatsu SI, et al. Gene therapy for a mouse model of glucose transporter-1 deficiency syndrome. Mol Genet Metab Rep. 2017; 10: 67-74.
全文PDFは以下からダウンロードできます。
JaSMIn通信特別記事No.16(伊藤先生)