JaSMIn通信特別記事No.17
作成日:2018.04.02
ホモシスチン尿症:
新生児マススクリーニングで見つかるもの、見つからないもの
東北大学大学院医学系研究科小児病態学分野 坂本 修
1.はじめに
ホモシスチン尿症は、メチオニンの代謝産物であるホモシステインが体内に蓄積することにより発症します。ホモシステインが二つくっついたものがホモシスチンであり、ホモシスチン尿症のお子さんでは尿中にホモシスチンが認められます(図1)。
ホモシスチン尿症は、新生児マススクリーニング開始当初(1977年)から対象疾患とされ、現在のタンデムマスによる検査法でも検査されています。
しかしながらホモシスチン尿症には3種類あります(細かく数えるともっと増えます)。新生児マススクリーニングで発見されるのはシスタチオニンβ合成酵素(CBS)欠損症(ホモシスチン尿症I型や古典型ホモシスチン尿症とも称され、ホモシスチン尿症の代表格です)のみであり、他の型は検出されません。
今回は「ホモシスチン尿症:新生児マススクリーニングで見つかるもの、見つからないもの」として、各疾患の仕組みとそれに対する現在の取り組みや問題点をお話します。
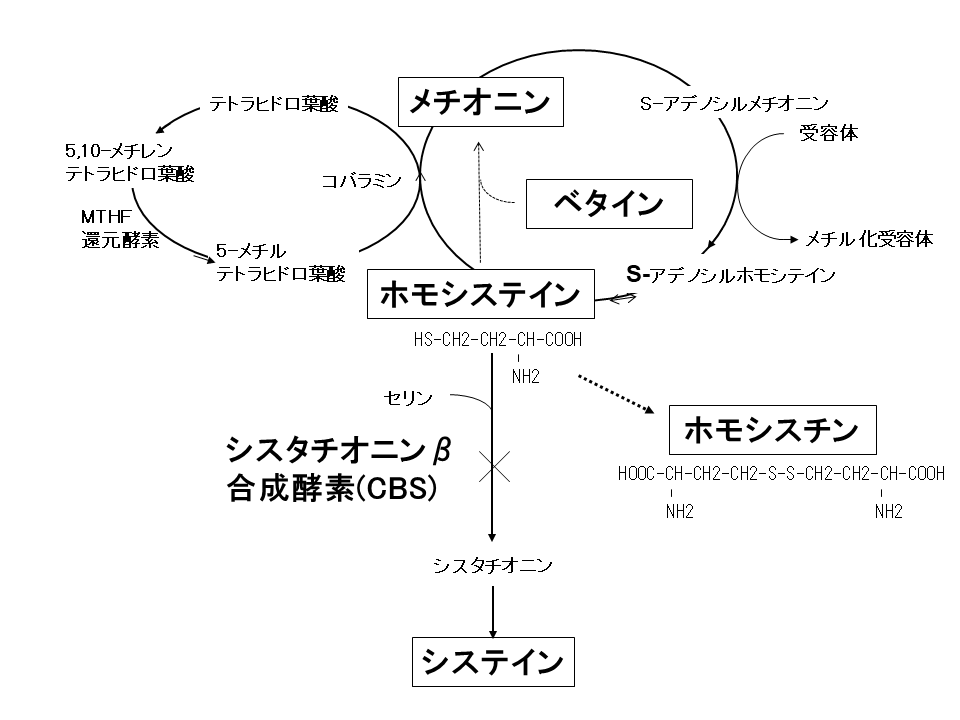
図1 ホモシステインの代謝:ホモシステインにはシステインになる経路とメチオニンに戻る経路がある
2.ホモシステイン代謝のメカニズム
ホモシステインは二つの代謝経路の分岐点に存在します(図1)。一つはシステインへと代謝される経路(硫黄転移反応経路)、もう一つはメチオニンに戻る経路です(再メチル化経路)。
前に話したとおり新生児マススクリーニングの対象疾患になっているのは、I型であるシスタチオニンβ合成酵素(CBS)欠損症です。シスタチオニンβ合成酵素(CBS)は硫黄転移経路の入口に位置し、ホモシステインとセリンからシスタチオニンを合成します。よって、シスタチオニンβ合成酵素(CBS)の活性低下によりホモシステインが蓄積し、さらにそれがもう一方の経路(つまりメチオニンに戻る経路)をながれ、メチオニンも増加します。新生児マススクリーニングでは、メチオニン高値[カットオフ値1.0~ 1.2 mg/dL (67~80 μmol/L)]を指標としてシスタチオニンβ合成酵素(CBS)欠損症(ホモシスチン尿症I型)の拾い上げをしています。
一方でメチオニンに戻る経路の障害もあります(図2)。II型(コバラミン代謝異常症;コバラミンはビタミンB12のことです)およびIII型(メチレンテトラヒドロ葉酸還元酵素(MTHFR)欠損症)がこれにあたります。これらにおいては、ホモシステインはメチオニンには戻れない(血中メチオニンは低値~正常値)ため、メチオニンを指標とする現行の新生児マススクリーニングではホモシスチン尿症としての拾い上げができません。
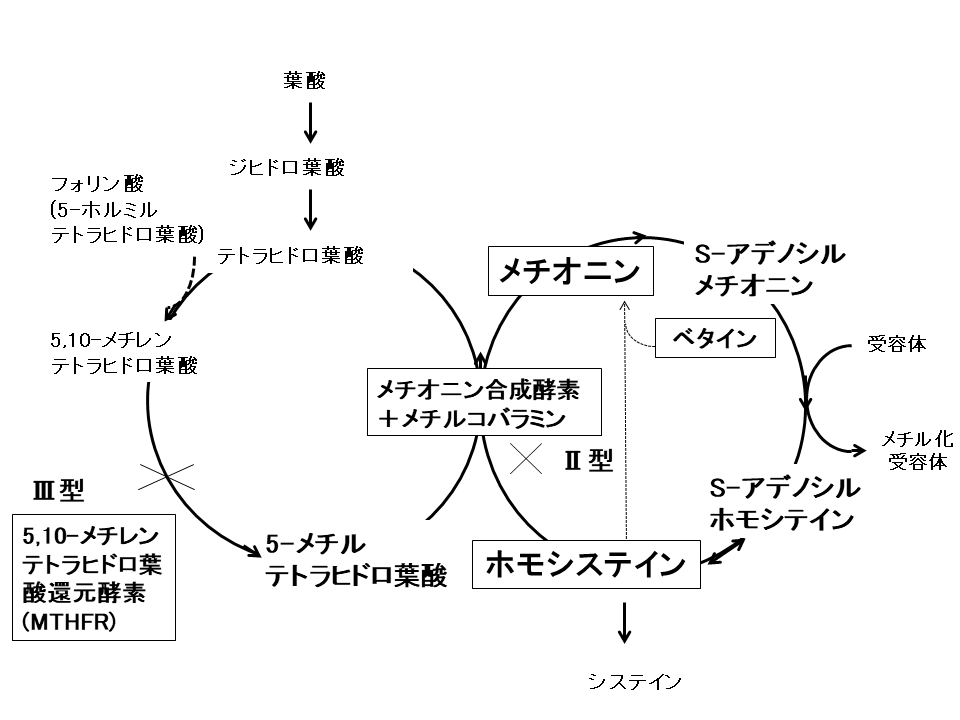
図2 ホモシステインの再メチオニン化:ホモシステインがメチオニンに戻るにはコバラミン(メチルコバラミン)、葉酸が必要である
3.病型と現在の取り組み、問題点
次から各型の説明と現在の取り組みや問題点をお話します。
1)シスタチオニンβ合成酵素(CBS)欠損症(ホモシスチン尿症I型)
前にお話ししたとおり、新生児マススクリーニング導入当時から検査がなされ、診断がつき次第メチオニン除去ミルクで治療がされています。治療がなされない場合(およびコントロールの悪い場合)の症状は以下のとおりです。
①知的障害・てんかんなどの中枢神経系の異常
②骨粗鬆症や高身長・クモ状指・側弯症・鳩胸・凹足・外反膝などの骨格の異常(マルファン症候群様体型)
③水晶体亜脱臼:無治療の場合8歳ころまでに認められる
④血栓症(冠動脈血栓症、肺塞栓、脳血栓塞栓症など):無治療の場合10代後半から認められる。生命予後を規定する因子となる。
新生児マススクリーニング発見時にはこれらの症状は見られません。そのため採血して、血漿メチオニン値 1.2 mg/dL以上(基準値 0.3~0.6)および血漿総ホモシステイン値 60 μmol/L以上(基準値 15以下)を指標として、生化学的に診断確定をします。遺伝子検査などは必要に応じて行われます。
治療の目標は、血中ホモシステイン値を低下させることになります。前にお話ししたとおり、診断後速やかに治療用ミルク[雪印メチオニン除去粉乳(S26)]を使用しメチオニン摂取制限を実施して、血漿メチオニン値を1 mg/dL以下に保つようにします。ただし、メチオニンは必須アミノ酸(人体では産生できず、食事からの摂取が必要なアミノ酸)であるので、完全な除去にしてはいけません。
また、シスタチオニンβ合成酵素(CBS)欠損症の一部でビタミンB6(ピリドキシン)の大量投与が著効します。欧州では半数近くの患者がこの型である地域がありますが、残念ながら日本では少ないです。生後6か月以降に、ピリドキシン大量投与(40mg/kg/day)を行いB6反応型か不応型かの判定を行います。また、p.I278T変異はB6反応型を呈する変異として知られています。
幼児期以降は除去ミルクを用いた食事療法のみではコントールが困難になってくることが多いです。ベタインという物質があり、日常では食品添加物(甘味・うま味)や保湿剤として使用されています。ホモシスチン尿症においてはベタイン(サイスタダン®)投与により再メチル化の代替経路を亢進させ、過剰なホモシステインをメチオニンに変えることができます。この場合、コントロールの指標としてメチオニンは使用できませんので、血漿総ホモシステイン値を測定します(50 μmol/Lを目標)。また、ベタイン療法中に脳浮腫をきたした症例が報告され、高メチオニン血症がその原因として推察されているため、食事療法を中止することなく、血漿メチオニン値は15 mg/dL (1000 μmol/L)以下に維持するようにします。
前にお話ししたように、血栓症(冠動脈血栓症、肺塞栓、脳血栓塞栓症など)が生命予後を規定する因子となります。血栓予防のためアスピリン、ジピリダモールなどの投与がなされることもあります。ベタイン、メチオニン制限、(B6反応型の場合にはビタミンB6)の治療は一生涯を通じて行う必要があります。しかしながら、現時点で指定難病に認められていないため、成人期の医療費上の負荷が免れません。
2)コバラミン代謝異常症(ホモシスチン尿症II型)
コバラミンはビタミンB12(目薬などに入っている赤いビタミンです)の化学名です。コバラミンは体内でメチルコバラミン(MeCbl)とアデノシルコバラミン(AdoCbl)に代謝されます。メチルコバラミン(MeCbl)はメチオニン合成酵素とともに働いて、ホモシステインをメチオニンにします。アデノシルコバラミン(AdoCbl)はメチルマロニルCoAムターゼととも働くため、働きが悪いとメチルマロン酸血症になります。またメチルコバラミン(MeCbl)、アデノシルコバラミン(AdoCbl)の合成に入る前に、共通の処理経路があります(図3)。
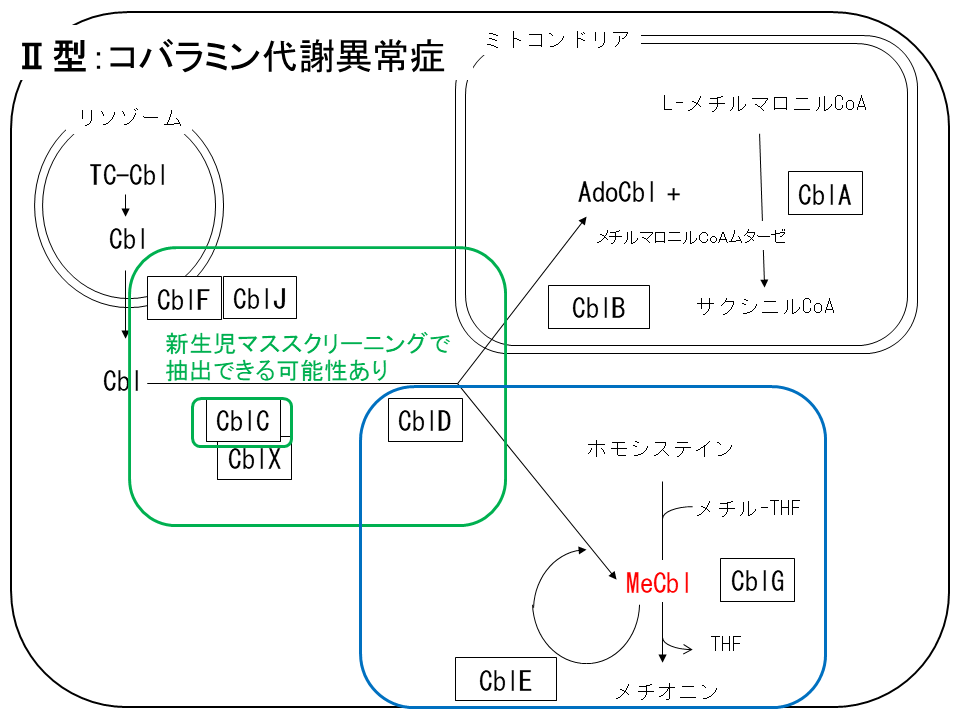
図3 コバラミンの代謝異常:多くの型がある(最多なのはCblC型)。緑枠の障害はメチルマロン酸血症も認めるため、そちらからスクリーニングできる可能性がある。
この図3にあるようにこれらの過程にいくつもの酵素が関わっており(図のCbl〇)、前にお話ししたとおりホモシスチン尿症II型といってもCblC-J,Xの型に分かれます(メチルコバラミン(MeCbl)合成に関わらないCblA, Bはメチルマロン酸血症のみで、ホモシスチン尿症にはなりません)。しかしながら、大雑把にいえばホモシスチン尿症にメチルマロン酸血症を伴う群(緑囲み)と伴わない群に分かれます(青囲み)。さらにコバラミン代謝異常症で最も頻度が高いのはCblC型であり、ホモシスチン尿症を伴うメチルマロン酸血症の型であるため、メチルマロン酸血症疑いとして新生児マスクリーニングにて発見される例があります。
CblC型コバラミン代謝異常症の多くは乳幼児期に体重増加不良、眼振、発達遅滞、巨赤芽球性貧血などで発症します。また、大人になってから発症するタイプもあります。心奇形合併例や肺高血圧、溶血性尿毒症症候群(大腸菌O157での腎症状に似たもの)で発症する例もあり、必ずしもI型と症状が一致しません。
治療としてCblCでは、ヒドロキソコバラミン(これもビタミンB12の一種)の筋肉注射が原則とされます。また、I型でお話ししたベタインの内服も行います。
中国においてはメチルマロン酸血症の約半数はCblCであるとされます。日本においては極めてまれであり、遺伝子診断で確認された症例は数例にすぎませんが、今後タンデムによる新生児マスクリーニングによって発見される例が増えてくる可能性があります。
3)メチレンテトラヒドロ葉酸還元酵素(MTHFR)欠損症(ホモシスチン尿症III型)
もう一つメチオニンができないタイプがIII型です(図2)。メチレンテトラヒドロ葉酸還元酵素(MTHFR)という葉酸(これもビタミンの一種)を代謝する酵素の障害によります。I型と症状が大きく異なり、乳児期早期から脳室拡大、筋緊張低下、無呼吸発作、けいれんなどで発症するものや、思春期以降四肢麻痺や白質脳症で発症します。メチオニンのメチル基はクレアチン、カルニチン、DNA、など神経(およびその他の組織)を作りあげるのに重要なアミノ酸です。そのメチオニンの合成障害がIII型の症状の発生に関連していると考えられています。
よって治療としてメチオニンを増やすことが考えられ、III型にもベタインを投与します。早期から投与することで死亡率低下や発達低下防止が報告されています。
そのように早期治療が有効なIII型ですが、I型のようにメチオニンが高くなるわけでもなく、II型(の一部)のようにC3カルニチンが高くなるわけでもないので、現行の新生児マススクリーニングで拾い上げが困難です。現時点では症状がある児に対して、①血漿メチオニンの低下、②血漿総ホモシステインの上昇、③尿中メチルマロン酸がでていない(つまりII型ではない)ことを証明することで診断しているため、経験に頼る部分が多くなります。
これを克服するための取り組みが一部の研究室で試みられています。単純なのは新生児マススクリーニングにてメチオニン低値(もしくはメチオニン値を同時測定の別の指標(例えばフェニルアラニン)で割ったもの)のものも拾い上げるということです。しかしながら、この場合には、正常と被りが多くて現実的ではないとされています。
そのほかに、新生児マススクリーニングにて直接ホモシステインを測ってしまうという考え方があります。この方法だとIII型に限らずI、II型も拾いあげられます。新生児マススクリーニング全例に実施するのか、それともメチオニン低下(および上昇)などで一次的に拾い上げた者に対しての二次検査にするのかや、指標値をどうするかなど試行されていますが、今後期待が大きい方法です。
新生児マススクリーニングの恩恵がII型・III型の児にも届くことを祈念します。
全文PDFは以下からダウンロードできます。
JaSMIn通信特別記事No.17(坂本先生)

